lunes, 7 de abril de 2014
jueves, 3 de abril de 2014
ENLACES QUÍMICOS:UNIONES ENTRE ÁTOMOS
.jpg)
¿POR QUÉ SE UNEN LOS ÁTOMOS?
El gas Neón, de símbolo químico Ne, existe en la naturaleza en forma de átomos libres de dicho elemento químico, pero el oxígeno que respiramos no se halla en forma de átomos libres, sino que se encuentra en forma de moléculas diatómicas, de fórmula O2. Asimismo, el agua es un compuesto químico formado por moléculas, cuya fórmula H20 indica que en cada molécula se unen dos átomos de hidrógeno con uno de oxígeno.¿Por qué en el caso de unos elementos químicos los átomos no se unen y en otros casos sí que lo hacen para formar diversas sustancias? La respuesta está en la tendencia que gobierna todos los cambios químicos y es la de encontrar una situación de mayor estabilidad.
 Los átomos de gas Neón no se unen entre sí porque dichos átomos
aislados son especies químicas estables, es decir, tienen su última capa electrónica
completa. Por el contrario, los átomos aislados de oxígeno son menos estables
que las moléculas de oxígeno y, por ello, se unen para formar una especie química
de mayor estabilidad, la molécula de oxígeno.
Los átomos de gas Neón no se unen entre sí porque dichos átomos
aislados son especies químicas estables, es decir, tienen su última capa electrónica
completa. Por el contrario, los átomos aislados de oxígeno son menos estables
que las moléculas de oxígeno y, por ello, se unen para formar una especie química
de mayor estabilidad, la molécula de oxígeno.Igualmente, se puede decir lo mismo del agua, donde una molécula formada por la unión de un átomo de oxígeno con dos átomos de hidrógeno es una situación mucho más estable que la de dichos átomos por separado.
Dado que los átomos se pueden unir para formar especies químicas más estables, ¿cómo se establece la unión entre los átomos? La respuesta es: Los átomos se unen mediante los electrones más externos de la corteza atómica para alcanzar una situación de mayor estabilidad.
Como los gases nobles son los elementos químicos que no manifiestan tendencia a unirse, es lógico pensar que dichos elementos químicos constituyen el referente químico de estabilidad.
Por tanto: La unión entre átomos ocurre a través de los electrones más externos de la corteza atómica para alcanzar la estructura electrónica de un gas noble.
Según cómo tenga lugar la unión a través de los electrones existen tres tipos de enlace químico: iónico, covalente y metálico.
ENLACE IÓNICO
 Este
enlace se produce cuando átomos de
elementos metálicos (especialmente los situados más a la izquierda en
la tabla periódica -períodos 1, 2 y 3) se encuentran con átomos no
metálicos (los elementos situados a la derecha en la tabla periódica
-especialmente los períodos 16 y 17).
Este
enlace se produce cuando átomos de
elementos metálicos (especialmente los situados más a la izquierda en
la tabla periódica -períodos 1, 2 y 3) se encuentran con átomos no
metálicos (los elementos situados a la derecha en la tabla periódica
-especialmente los períodos 16 y 17).En este caso los átomos del metal ceden electrones a los átomos del no metal, transformándose en iones positivos y negativos, respectivamente. Al formarse iones de carga opuesta éstos se atraen por fuerzas eléctricas intensas, quedando fuertemente unidos y dando lugar a un compuesto iónico. La fuerza eléctrica que mantiene unidos los iones de signo contrario se denomina enlace iónico.
En un compuesto iónico la atracción entre cargas de distinto signo hace que los iones se dispongan de manera ordenada. Cada catión se rodea de aniones y cada anión de cationes, formando una gran estructura.
Ejemplo: La sal común se forma cuando los átomos del gas cloro se ponen en contacto con los átomos del metal sodio.
Propiedades de los cristales iónicos:
- Poseen altos puntos de fusión y ebullición.
- No conducen la electricidad en estado sólido.
- Conducen la electrcidad cuando están fundidos.
- Se disuelven muy bien en agua.
- Las disoluciones acuosas conducen la electricidad.
ENLACE COVALENTE
.jpg)
.jpg) Los
enlaces covalentes son las fuerzas que mantienen unidos entre sí
los átomos no metálicos (los elementos situados a la derecha en la
tabla periódica -C, O, F, Cl, ...).
Los
enlaces covalentes son las fuerzas que mantienen unidos entre sí
los átomos no metálicos (los elementos situados a la derecha en la
tabla periódica -C, O, F, Cl, ...).Estos átomos tienen muchos electrones en su nivel más externo (electrones de valencia) y tienen tendencia a ganar electrones más que a cederlos, para adquirir la estabilidad de la estructura electrónica de gas noble. Por tanto, los átomos no metálicos no pueden cederse electrones entre sí para formar iones de signo opuesto.
En este caso el enlace se forma al compartir un par de electrones entre los dos átomos, uno procedente de cada átomo. El par de electrones compartido es común a los dos átomos y los mantiene unidos, de manera que ambos adquieren la estructura electrónica de gas noble. Se forman así habitualmente moléculas: pequeños grupos de átomos unidos entre sí por enlaces covalentes.
Ejemplo: El gas cloro está formado por moléculas, Cl2, en las que dos átomos de cloro se hallan unidos por un enlace covalente.
Propiedades de las sustancias covalentes:
 - Las sustancias covalentes simples se hallan a menudo, a temperatura y presión ordinaria, en estado gaseoso o líquido, formando moléculas perfectamente definidas. Los sólidos moleculares tienen temperaturas de fusión y ebullición bajas. Por el contrario, los sólidos covalentes cristalinos, como el cuarzo, tienen temperaturas de fusión y ebullición altas.
- Las sustancias covalentes simples se hallan a menudo, a temperatura y presión ordinaria, en estado gaseoso o líquido, formando moléculas perfectamente definidas. Los sólidos moleculares tienen temperaturas de fusión y ebullición bajas. Por el contrario, los sólidos covalentes cristalinos, como el cuarzo, tienen temperaturas de fusión y ebullición altas.- Las sustancias covalentes no son conductoras de la electricidad, incluso ni cuando están fundidas o disueltas, pues no tienen iones o electrones libres.es, que son los causantes del fenómeno de la conducción de la electricidad.
- Los sólidos covalentes moleculares, como el fósforo o los compuestos químicos orgánicos, como los aceites y las grasas, se disuelven en disolventes orgánicos como la gasolina o el tetracloruro de carbono y no en disolventes inorgánicos como el agua. Además los sólidos covalentes son frágiles y quebradizos o blandos y de aspecto ceroso.
ENLACE METÁLICO
Para explicar las propiedades características de los metales (su alta conductividad eléctrica y térmica, ductilidad y maleabilidad, ...) se ha elaborado un modelo de enlace metálico conocido como modelo de la nube o del mar de electrones:
Los átomos de los metales tienen pocos electrones en su última capa, por lo
general 1, 2 ó 3. Éstos átomos pierden fácilmente esos electrones (electrones
de valencia) y se convierten en iones positivos, por ejemplo Na+, Cu2+,
Mg2+. Los iones positivos resultantes se ordenan en el espacio
formando la red metálica. Los electrones de valencia desprendidos de los átomos
forman una nube de electrones que puede desplazarse a través de toda la red. De
este modo todo el conjunto de los iones positivos del metal queda unido
mediante la nube de electrones con carga negativa que los envuelve.
Propiedades de los metales:
- La mayoría son muy duros.
- Son dúctiles y maleables.
- Conducen la corriente eléctrica.
Propiedades de los metales:
- La mayoría son muy duros.
- Son dúctiles y maleables.
- Conducen la corriente eléctrica.
CONCEPTOS BÁSICOS SOBRE ÁTOMOS
SUSTANCIAS SIMPLES
Las sustancias simples están formadas por uno o varios átomos de un mismo elemento.
Las fórmulas de las sustancias simples están formadas por el símbolo del elemento y un subíndice que indica el número de átomos iguales que lo forman.
Estas moléculas (unión de 2 o más átomos de un mismo elemento o de diferentes elementos) se nombran según la nomenclatura sistemática (IUPAC) que antepone un prefijo numeral al nombre del elemento.
NOMENCLATURA SISTEMÁTICA = PREFIJO DE CANTIDAD + ELEMENTO
 1-Mono. Ejemplo: Monoplata o plata
1-Mono. Ejemplo: Monoplata o plata
2-Di. Ejemplo: Dioxígeno
3- Tri. Ejemplo: Trioro
4- Tetra. Ejemplo: Tetrafósforo
5- Penta. Ejemplo: Pentanitrógeno
6- Hexa.
7- Hepta.
8- Octo. Ejemplo: Octoazufre
Podemos encontrar las sustancias simples:
- Como átomos aislados: los gases nobles.
Los elementos del grupo 18, se encuentran en la naturaleza en forma de átomos aislados. A temperatura ambiente son sustancias gaseosas.
Una de las características de los elementos del grupo 18 es que todos tienen ocho electrones en su capa más externa, excepto el helio que tiene solo dos. Esta estructura es la más estable posible.
Por otra parte, el hecho de que los átomos de estos elementos tengan una estructura electrónica tan estable hace que no suelan combinarse ni consigo mismos ni con los átomos de otros elementos; de ahí que sean denominados gases nobles o inertes.
- Formando moléculas
- Formando cristales (sólidos cuyas partículas se ordenan conforme a un patrón que se repite en las tres direcciones del espacio)
COMPUESTOS
Los compuestos están formados por la unión de varios elementos diferentes combinados en proporciones fijas, y que se pueden separar por métodos químicos. Se representan mediante fórmulas químicas. Los subíndices indican el número de átomos de cada elemento.
Los átomos de elementos diferentes se unen entre sí para formar compuestos. Estas agrupaciones de átomos pueden ser en forma de moléculas o en forma de cristales.
- En forma de moléculas.
- En forma de cristales.
Las sustancias simples están formadas por uno o varios átomos de un mismo elemento.
Las fórmulas de las sustancias simples están formadas por el símbolo del elemento y un subíndice que indica el número de átomos iguales que lo forman.
Estas moléculas (unión de 2 o más átomos de un mismo elemento o de diferentes elementos) se nombran según la nomenclatura sistemática (IUPAC) que antepone un prefijo numeral al nombre del elemento.
NOMENCLATURA SISTEMÁTICA = PREFIJO DE CANTIDAD + ELEMENTO
 1-Mono. Ejemplo: Monoplata o plata
1-Mono. Ejemplo: Monoplata o plata2-Di. Ejemplo: Dioxígeno
3- Tri. Ejemplo: Trioro
4- Tetra. Ejemplo: Tetrafósforo
5- Penta. Ejemplo: Pentanitrógeno
6- Hexa.
7- Hepta.
8- Octo. Ejemplo: Octoazufre
Podemos encontrar las sustancias simples:
- Como átomos aislados: los gases nobles.
Los elementos del grupo 18, se encuentran en la naturaleza en forma de átomos aislados. A temperatura ambiente son sustancias gaseosas.
Una de las características de los elementos del grupo 18 es que todos tienen ocho electrones en su capa más externa, excepto el helio que tiene solo dos. Esta estructura es la más estable posible.
Por otra parte, el hecho de que los átomos de estos elementos tengan una estructura electrónica tan estable hace que no suelan combinarse ni consigo mismos ni con los átomos de otros elementos; de ahí que sean denominados gases nobles o inertes.
- Formando moléculas
- Formando cristales (sólidos cuyas partículas se ordenan conforme a un patrón que se repite en las tres direcciones del espacio)
COMPUESTOS
Los compuestos están formados por la unión de varios elementos diferentes combinados en proporciones fijas, y que se pueden separar por métodos químicos. Se representan mediante fórmulas químicas. Los subíndices indican el número de átomos de cada elemento.
Los átomos de elementos diferentes se unen entre sí para formar compuestos. Estas agrupaciones de átomos pueden ser en forma de moléculas o en forma de cristales.
- En forma de moléculas.
- En forma de cristales.
ABUNDANCIA EN LA NATURALEZA
De los 117
elementos que se conocen actualmente, 29 han sido producidos artificialmente en
las últimas décadas y no se encuentran en la naturaleza.
De los 88
restantes, más de 70 son tan escasos que reciben el nombre de elementos traza.
Al analizar la
materia que compone el universo, se descubren dos hechos:
-
Los
elementos que constituyen los diversos cuerpos celestes son prácticamente
iguales en todo el universo.
-
La
abundancia de los elementos químicos, e incluso de sus isótopos, es similar en
todos los cuerpos del universo.
Los elementos en
la Tierra
Al analizar la
materia que constituye la Tierra se han encontrado en estado libre el oxígeno,
el nitrógeno, el carbono, el oro, la plata y el platino. El resto de los
elementos se halla combinado con otros elementos.
EN LA ATMÓSFERA
En la atmósfera,
los elementos más abundantes son el nitrógeno, el oxígeno (libre, y combinado
con el hidrógeno formando vapor de agua), el hidrógeno (casi en su totalidad
combinado con el oxígeno en el vapor de agua), el carbono (combinado con el
oxígeno formando dióxido de carbono) y el argón.
EN LA CORTEZA TERRESTRE
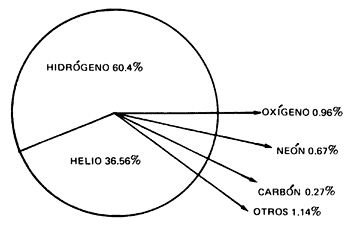
 En el
gráfico de abundancia de los elementos que parece a la derecha, podrás comprobar que el silicio ocupa
el segundo lugar en la corteza terrestre, tras el oxígeno. El silicio forma
parte de la arena, la arcilla, el asbesto y la mica. Por ejemplo, el 47% de la
arena del desierto está formada por silicio.
En el
gráfico de abundancia de los elementos que parece a la derecha, podrás comprobar que el silicio ocupa
el segundo lugar en la corteza terrestre, tras el oxígeno. El silicio forma
parte de la arena, la arcilla, el asbesto y la mica. Por ejemplo, el 47% de la
arena del desierto está formada por silicio.
En la hidrosfera
el segundo elemento más abundante es el hidrógeno que está combinado con el
oxígeno en el agua.
Los elementos en los seres vivos
Del centenar de
elementos conocidos, menos de 30 forman parte de la materia viva.
Los elementos
que entran en la constitución de los seres vivos reciben el nombre de
bioelementos.
Nuestro organismo
está compuesto, fundamentalmente, por átomos de carbono, oxígeno, hidrógeno y
nitrógeno y, en menor proporción, de fósforo y azufre. Todos ellos son
denominados bioelementos primarios y aportan el 96,2% del total.
Los bioelementos
más abundantes en los seres vivos son:
 -
El
oxígeno, que se encuentra libre en la naturaleza, es elaborado por las plantas
mediante la fotosíntesis.
-
El
oxígeno, que se encuentra libre en la naturaleza, es elaborado por las plantas
mediante la fotosíntesis.
-
El
carbono es unas doscientas veces más abundante en la biosfera que el la litosfera.
Es el elemento
básico para la formación de las moléculas de los seres vivos, por lo que es
captado directamente de la atmósfera en forma de dióxido de carbono por las plantas y a través
de los alimentos, por los animales.
-
El
hidrógeno se encuentra combinado con el oxígeno en el agua y con el carbono y
otros elementos en las diferentes moléculas que constituyen la materia viva.
SISTEMA PERIÓDICO
La tabla
periódica actual
En la tabla
periódica actual, los elementos aparecen ordenados de izquierda a derecha y de
arriba abajo, en orden creciente de números atómicos.
Los elementos
dentro de la tabla periódica están organizados en:
-
Grupos:
Los elementos con el mismo número de electrones en su última capa (electrones
de valencia) y, por lo tanto, con propiedades similares, se encuentran en un
mismo grupo. Hay 18 grupos numerados del 1 a l8 formando columnas.
-
Periodos:
Los elementos con el mismo número de capas electrónicas se encuentran en un
mismo periodo. Hay 7 periodos formando filas.
Los
inconvenientes de la tabla periódica actual son:
-
El
hidrógeno no ocupa un lugar adecuado en la tabla, pues sus propiedades no se
parecen a las de ninguno de los electos de los distintos grupos. Está situados
en el grupo 1 por tener solo1 electrón.
-
Los
elementos con números atómicos del 58 al 71 y del 90 al 103 no están situados
dentro de la tabla.
Los metales y los
no metales en la tabla periódica
Para saber dónde
están situados los elementos metálicos y los no metálicos en la tabla
periódica, hay que tener en cuenta lo siguiente:
-
Dentro
de un mismo periodo, las propiedades metálicas de los elementos se acentúan a
medida que nos desplazamos a la izquierda y disminuyen conforme vamos hacia la
derecha.
-
Dentro
de un mismo grupo, las propiedades metálicas de los elementos se acentúan a
medida que bajamos en la tabla y disminuye conforme subimos por ella.
CLASIFICACIÓN DE LOS ELEMENTOS QUÍMICOS
La primera clasificación de los elementos, atendiendo a su aspecto y propiedades físicas, distinguió entre metales y no metales.
Características
de los elementos: Cobre
Poseen un brillo
característico (lustre metálico).
Son opacos.
Son buenos
conductores del calor y de la corriente eléctrica.
Son metales y
dúctiles, es decir, pueden formar láminas delgadas y alambres.
Con excepción del
mercurio, son sólidos a temperatura ambiente, y
la mayoría tiene elevados
puntos de fusión.
- No metálicos:
No poseen brillo
metálico.
Son malos conductores
del calor y de la electricidad.
A temperatura
ambiente pueden ser sólidos, líquidos o gases.
En estado sólido
son frágiles, esto es, se rompen con facilidad.
Por lo general,
los sólidos tienen puntos de fusión bajos, y los líquidos, puntos de ebullición
también bajos.
azufre
Suscribirse a:
Comentarios (Atom)


.jpg)