De los 117
elementos que se conocen actualmente, 29 han sido producidos artificialmente en
las últimas décadas y no se encuentran en la naturaleza.
De los 88
restantes, más de 70 son tan escasos que reciben el nombre de elementos traza.
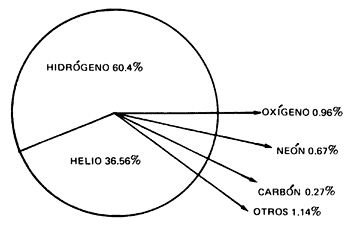 Los elementos en
el universo
Los elementos en
el universo
Al analizar la
materia que compone el universo, se descubren dos hechos:
-
Los
elementos que constituyen los diversos cuerpos celestes son prácticamente
iguales en todo el universo.
-
La
abundancia de los elementos químicos, e incluso de sus isótopos, es similar en
todos los cuerpos del universo.
Los elementos en
la Tierra
Al analizar la
materia que constituye la Tierra se han encontrado en estado libre el oxígeno,
el nitrógeno, el carbono, el oro, la plata y el platino. El resto de los
elementos se halla combinado con otros elementos.
EN LA ATMÓSFERA
En la atmósfera,
los elementos más abundantes son el nitrógeno, el oxígeno (libre, y combinado
con el hidrógeno formando vapor de agua), el hidrógeno (casi en su totalidad
combinado con el oxígeno en el vapor de agua), el carbono (combinado con el
oxígeno formando dióxido de carbono) y el argón.
EN LA CORTEZA TERRESTRE
 En el
gráfico de abundancia de los elementos que parece a la derecha, podrás comprobar que el silicio ocupa
el segundo lugar en la corteza terrestre, tras el oxígeno. El silicio forma
parte de la arena, la arcilla, el asbesto y la mica. Por ejemplo, el 47% de la
arena del desierto está formada por silicio.
En el
gráfico de abundancia de los elementos que parece a la derecha, podrás comprobar que el silicio ocupa
el segundo lugar en la corteza terrestre, tras el oxígeno. El silicio forma
parte de la arena, la arcilla, el asbesto y la mica. Por ejemplo, el 47% de la
arena del desierto está formada por silicio.
En la hidrosfera
el segundo elemento más abundante es el hidrógeno que está combinado con el
oxígeno en el agua.
Los elementos en los seres vivos
Del centenar de
elementos conocidos, menos de 30 forman parte de la materia viva.
Los elementos
que entran en la constitución de los seres vivos reciben el nombre de
bioelementos.
Nuestro organismo
está compuesto, fundamentalmente, por átomos de carbono, oxígeno, hidrógeno y
nitrógeno y, en menor proporción, de fósforo y azufre. Todos ellos son
denominados bioelementos primarios y aportan el 96,2% del total.
Los bioelementos
más abundantes en los seres vivos son:
 -
El
oxígeno, que se encuentra libre en la naturaleza, es elaborado por las plantas
mediante la fotosíntesis.
-
El
oxígeno, que se encuentra libre en la naturaleza, es elaborado por las plantas
mediante la fotosíntesis.
-
El
carbono es unas doscientas veces más abundante en la biosfera que el la litosfera.
Es el elemento
básico para la formación de las moléculas de los seres vivos, por lo que es
captado directamente de la atmósfera en forma de dióxido de carbono por las plantas y a través
de los alimentos, por los animales.
-
El
hidrógeno se encuentra combinado con el oxígeno en el agua y con el carbono y
otros elementos en las diferentes moléculas que constituyen la materia viva.


.jpg)



.jpg)
.jpg)

.jpg)